

本试剂盒的核酸提取纯化为磁珠法,针对疫苗制剂的产品特点,优化了试剂配方,用于疫苗成品,如 Vero 细胞生产的狂犬病疫苗中的 Vero 残留 DNA 的样品前处理,可稳定高效地获得样品中的痕量 DNA,可与各个 SHENTEK®宿主细胞 DNA qPCR 检测试剂盒配合使用。
本试剂盒可以采用手动操作,也可以通过 rHCDpurify®实现样品的自动处理。
如样品中含有铝佐剂或右旋糖苷,具体处理方法可咨询湖州申科生物技术股份有限公司。
50 Extractions。
规定储存条件下 24 个月,具体详见试剂盒标签。
1. 无菌超纯水
2. 无水乙醇(分析纯)
3. 100%异丙醇(分析纯)
4. 5M 的 NaCl
5. 1M 的 HCl 和 NaOH
6. 1000 μL,100 μL,10 μL 无菌低吸附滤芯枪头
7. 1.5 mL 无菌低吸附离心管
8. PCR 八联管或 96 孔板,相应管盖或覆膜
1. 迷你离心机
2. 漩涡震荡器
3. 恒温水浴锅
4. 1000 μL,100 μL,10 μL 移液枪
5. 磁性分离架和 rHCDpurify®前处理系统
6. 荧光定量 PCR 仪
7. 96 孔微孔板混匀仪
n 实验操作流程
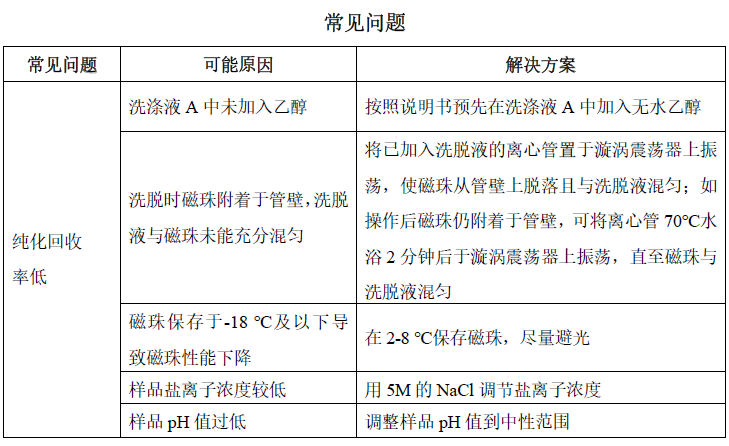
1. 在新开启的洗涤液 A 中加入 20 mL 的无水乙醇。
2. 在干净的试剂瓶中用无水乙醇和灭菌超纯水配制 70%乙醇溶液,标记为洗涤液 B。
3. 配制后的洗涤液应密封,室温保存,防止乙醇挥发。
4. 准备好 100%的异丙醇。
5. 使用前若发现结合液出现结晶或沉淀,应 37 ℃水浴,待完全溶解后,振荡混匀。
6. 使用前若发现样品缓冲液出现结晶或沉淀,应 37 ℃水浴,待完全溶解后,振荡混匀。
7. 使用前应提前将磁珠置于室温环境下平衡 10 分钟,使用前振荡均匀。
如果待检测样品是生物制品纯化过程中的上游中间样品,可能含有较高的 DNA 含量。为了保证检测的准确性,使样品的检测值在标准曲线线性范围之内,可以用灭菌超纯水对高 DNA 含量样品进行适当比例的稀释后再进行样品纯化处理;也可以在样品纯化处理完成之后,用稀释液对纯化处理后的样品进行稀释,然后再进行 DNA 残留检测。
若样品为干粉状态,可用稀释液将干粉样品进行溶解,再进行下一步操作;或先用适当的试剂将干粉样品溶解,配成高浓度溶液,再用稀释液稀释后,进行下一步操作。
pH 值要求:一般情况下生物制品纯化过程中间样品的 pH 值均为中性,若样品的 pH<5>9,则会影响样品纯化处理效果。因此可用 1M 的盐酸或氢氧化钠调整样品的 pH 至中性后(pH6.0-8.0)再进行纯化操作。
Ø 阴性对照(NCS):每次实验中都需要设置一个 NCS 作为空白样品,NCS与其他待测样品一起进行处理,以检验在样品处理过程中是否存在交叉污染或环境污染。
Ø 加标回收(ERC):用 ERC 来评估 DNA 提取的效率、回收率和准确度,并可用 ERC 来评估验证分析方法和系统性能。对具体样品的 DNA 加标量设定在其无加标测试值的 2-10 倍为宜。
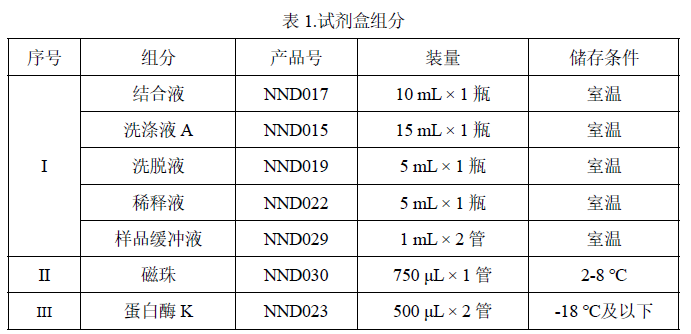
1. 取 100 μL 待检测样品到 1.5 mL 干净的离心管中,加入 10 μL 5M NaCl、30μL
样品缓冲液,用漩涡振荡器充分震荡 30 秒,取出快速离心 5 秒。
2. 加入 15 μL 蛋白酶 K,在漩涡振荡器上充分震荡 10 秒,取出快速离心 5 秒,放置在 55 ℃水浴 1 小时。
(一)操作过程(手工操作)
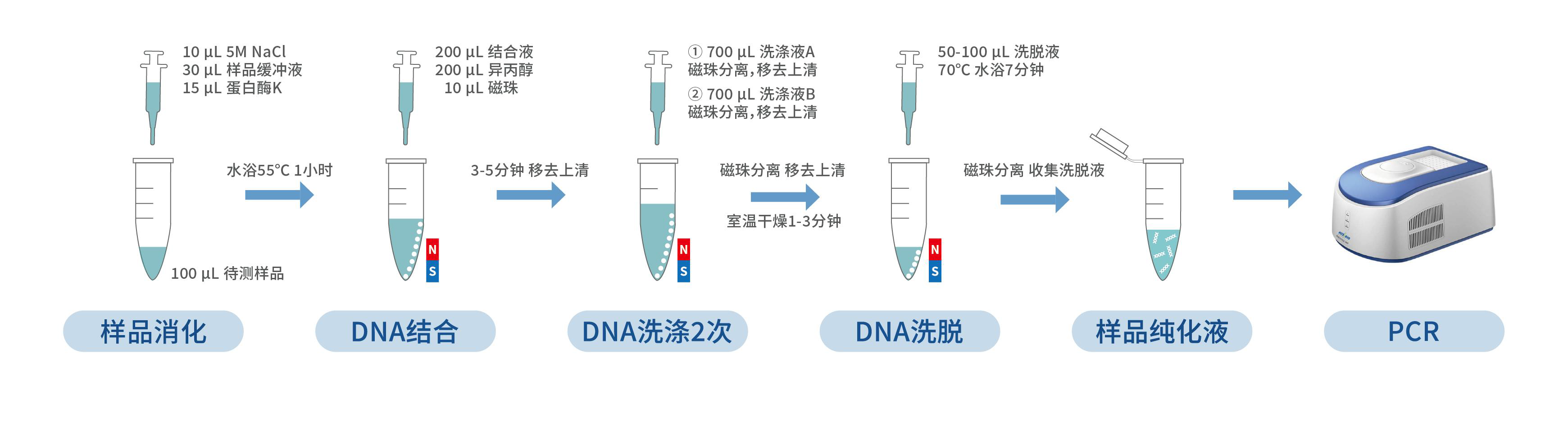
1. 将磁珠置于室温环境下 10 分钟,在漩涡振荡器充分振荡 5 秒。
磁珠可以根据实验量提前进行分装,避免环境温度反复导致结合能力降低。
2. 从水浴中取出样品,快速离心 30 秒,加入 200 μL 结合液,在漩涡振荡器上充分振荡 5 秒。
3. 快速离心 10 秒后在样品混合物中分别加入 200 μL 异丙醇,10 μL 磁珠。
4. 将装有全部混合物的离心管置于漩涡振荡器上振荡 5 分钟,快速离心 10 秒后静置于磁性分离架上。
快速离心的目的在于将附着在离心管盖和壁上的混合物甩至管底。
5. 待溶液澄清,磁珠完全分离后,用枪头小心移去上清。 ![]() 等待磁珠完全分离的时间约为 3-5 分钟。
等待磁珠完全分离的时间约为 3-5 分钟。
去除上清时枪头避免搅动磁珠,避免磁珠同上清一起被去除。
1. 从磁性分离架上取下含有磁珠的离心管,加入 700 μL 洗涤液 A,用漩涡振荡器振荡 10 秒使磁珠和洗涤液 A 混匀;快速离心 10 秒后,将离心管重置于磁性分离架上。待溶液澄清,磁珠完全分离后,用枪头移去上清液,完成第 1 次磁珠洗涤。
2. 从磁性分离架上取下含有磁珠的离心管,加入 700 μL 洗涤液 B,用漩涡振荡器振荡 40 秒使磁珠和洗涤液 B 混匀;快速离心 10 秒后,将离心管重置于磁性分离架上。待溶液澄清,磁珠完全分离后,用枪头移去上清液,完成第 2 次磁珠洗涤。
3. 为保证液体充分移除,可将离心管再次快速离心 10 秒,置于磁性分离架上,待磁珠完全分离后,用 10 μL 枪头小心的将残余液体吸除干净。
去除上清时枪头避免搅动磁珠,避免磁珠同上清一起被去除。
4. 从磁性分离架上取下离心管,打开管盖在室温下干燥 1-3 分钟,除去残留的乙醇。
干燥时间不可过长,室温较高或空气干燥的环境下可以适当缩短干燥时间,残留乙醇会影响下一步的检测反应。
1. 沿离心管壁加入 50-100 μL 洗脱液,用漩涡振荡器轻微振荡 3 秒使磁珠和洗脱液混匀,70 ℃水浴 7 分钟,水浴过程中可再次振荡混匀 2-3 次。
振荡时不要将磁珠和洗脱液振到管盖上。
洗脱时应使洗脱液与磁珠充分混合均匀,避免磁珠附着于离心管盖和壁上导致未能充分混匀。
2. 孵育完成后,将离心管快速离心 30 秒,然后静置于磁性分离架上,待磁珠分离后,用枪头小心转移溶液到干净的离心管中。
3. 将上一步获得的离心管快速离心 10 秒,然后静置于磁性分离架上,待磁珠分离后,用枪头再次转移溶液到干净离心管,所得即为样品纯化液。
收集洗脱液时,应将离心管内溶液转移完全,离心管内不得残留液体,否则将影响样品检测的准确性。
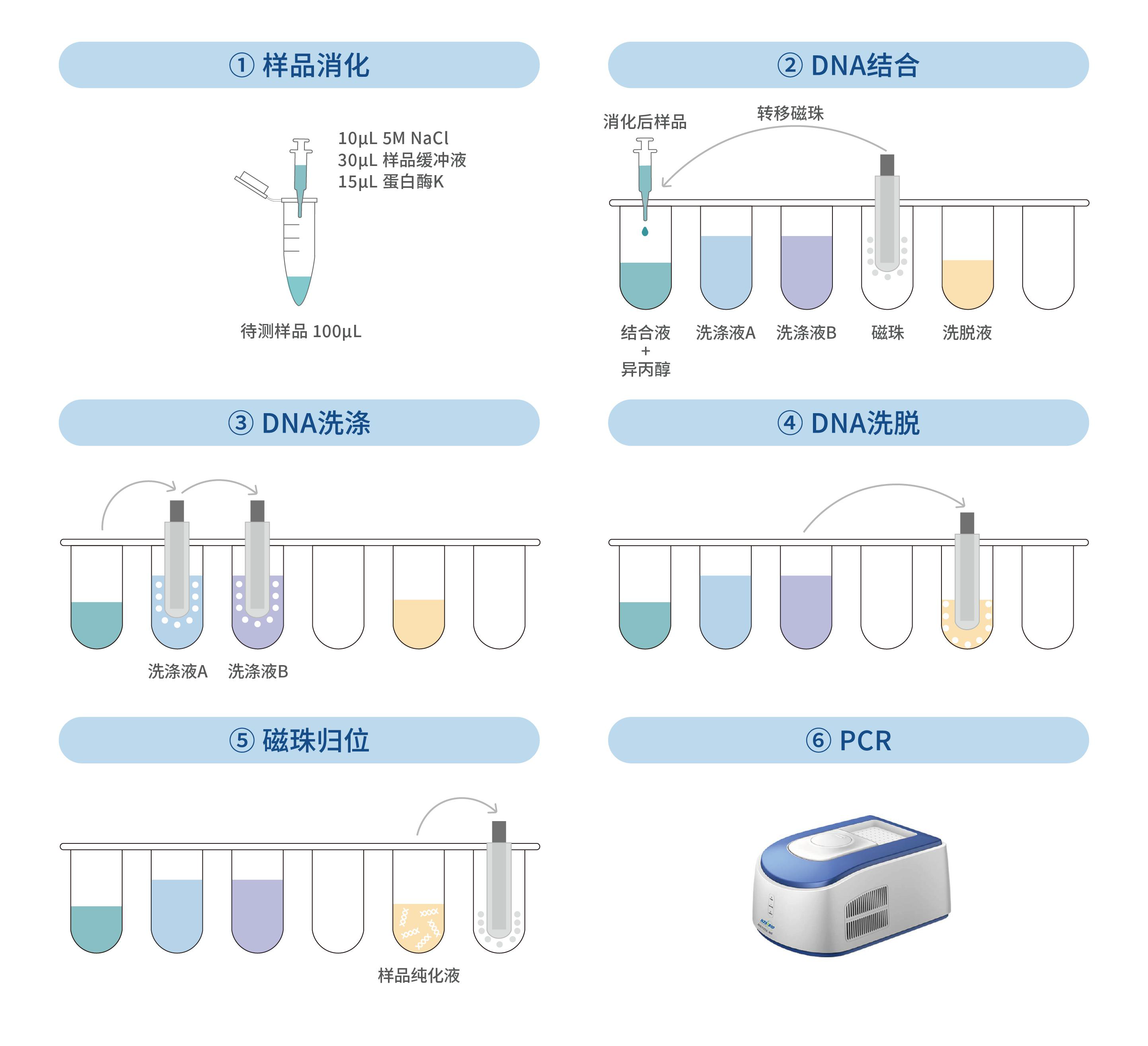
按照下述 96 深孔板排布预先加入相应溶液:
其中:
其中:
第 1 或 7 列:结合液 200 μL/孔,异丙醇 200 μL/孔,消化后的全部样品
第 2 或 8 列:洗涤液 A 700 μL/孔
第 3 或 9 列:洗涤液 B 700 μL/孔
第 4 或 10 列:磁珠 15 μL/孔
第 5 或 11 列:洗脱液 100 μL/孔
样品可在其他试剂全部加完后再加。
1. 电源键打开—点击“登录”输入账号及密码—进入主界面。
2. 75%酒精棉球擦拭仪器内壁—点击“紫外灯”—选择“15 分钟”。
此步骤可在提取准备操作之前进行。
3. 将加好样的 96 深孔板放入仪器中固定位置,并把塑料套管插入磁头对应位置。
4. 点击“运行”—选择“rHCD-06DM50”程序—扫描试剂盒上二维码—仪器运行。
5. 程序结束,发出“嘀嘀”声,立即取出深孔板,将样品纯化液全部转移到新的离心管内。
1. 建议将实验室内部进行分区,分为阴性区(阴性对照样品处理、PCR 试剂的配制、阴性模板加样)、阳性区(样品操作)、扩增区等,做好明显的标识。每个区域配备独立的设备、试剂及耗材,不得交叉使用。实验试剂、待测样品、PCR 产物应分开存放,不应放于同处。减少在实验区内不必要的走动,以降低污染发生概率。
2. 实验开始前确保实验室环境温度不低于 22 ℃。
3. 实验过程中选择最合适尺寸的手套并及时更换,在不同实验区域或进行模板操作后都应更换实验服、口罩、帽子及手套,以避免不同实验区域交叉污染。
4. 装有试剂的离心管在打开之前应先瞬时离心,将管壁及管盖上的液体离至管底,降低污染手套或移液枪的风险;谨慎开关反应管,防止管内液体溅出或形成气溶胶导致污染。
5. 使用过的枪头及废液必须经过消毒液浸泡消毒后,在远离实验室的场所丢弃或统一处理。
6. PCR 扩增完成后,需戴上一次性手套将 PCR 管取出,观察管盖是否紧闭,管壁有否破裂,确保产物没有外漏,之后丢弃在指定处,严禁开盖。
7. 在磁性分离架上分离磁珠时,过程中可缓慢旋转离心管,加速磁珠聚集。
8. DNA 洗涤和洗脱操作时,每次振荡混匀后,都应该瞬时离心,以保证没有磁珠或液体附着于离心管盖或管壁上。
9. 在去除乙醇干燥时,观察磁珠状态,勿让磁珠太干,以免洗脱时不完全溶解。
10. 请尽量在完成样品纯化处理当天进行后续的 DNA 检测,以保证检测结果的准确性。
11. rHCDpurify 程序启动前,检查 96 深孔板和套管是否固定好。
12. rHCDpurify 仪器工作前及完成后需要紫外灭菌至少 15 分钟,并使用 75%酒精棉球将仪器内壁擦拭干净。且两次提取实验间隔至少为 30 分钟。
13. rHCDpurify 程序运行完毕后,需立即取出 96 深孔板并将洗脱液转移至新的离心管。 96 深孔板第 5 或第 11 列壁上可能会出现冷凝水珠,该现象不会影响提取效果,只需将底部洗脱液转移出来即可,且保证多于 40 μL,确保检测时所需。
修订日期:2023 年 05 月 15 日
生效日期:2023 年 05 月 17 日




